Исследование системы гемостаза
Система гемостаза — совокупность функционально-морфологических и биохимических механизмов, обеспечивающих сохранение жидкого состояния крови, предупреждение и остановку кровотечений, а также целостность кровеносных сосудов.
В целостном организме при отсутствии каких-либо патологических воздействий жидкое состояние крови является следствием равновесия факторов, обусловливающих процессы свёртывания и препятствующих их развитию. Нарушение подобного баланса может быть вызвано очень многими факторами, однако вне зависимости от этиологических причин тромбо-образование в организме происходит по единым законам с включением в процесс определённых клеточных элементов, энзимов и субстратов.
В свёртывании крови различают два звена: клеточный (сосудисто-тром-боцитарный) и плазменный (коагуляционный) гемостаз.
■ Под клеточным гемостазом понимают адгезию клеток (то есть взаимодействие клеток с чужеродной поверхностью, в том числе и с клетками иного вида), агрегацию (склеивание одноименных клеток крови между собой), а также высвобождение из форменных элементов веществ, активирующих плазменный гемостаз.
■ Плазменный (коагуляционный) гемостаз представляет собой каскад реакций, в которых участвуют факторы свёртывания крови, завершающийся процессом образования фибрина. Образовавшийся фибрин подвергается далее разрушению под влиянием плазмина (фибринолиз).
Важно отметить, что деление гемостатических реакций на клеточные и плазменные условно, однако оно справедливо в системе in vitro и существенно облегчает выбор адекватных методик и интерпретацию результатов лабораторной диагностики патологии гемостаза. В организме эти два звена свёртывающей системы крови тесно связаны и не могут функционировать раздельно.
Очень важную роль в осуществлении реакций гемостаза играет сосудистая стенка. Эндотелиальные клетки сосудов способны синтезировать и/или экспрессировать на своей поверхности различные биологически активные вещества, модулирующие тромбообразование. К ним относятся фактор фон Виллебранда, эндотелиальный фактор релаксации (оксид азота), про-стациклин, тромбомодулин, эндотелин, активатор плазминогена тканевого типа, ингибитор активатора плазминогена тканевого типа, тканевой фактор (тромбопластин), ингибитор пути тканевого фактора и некоторые другие. Кроме того, мембраны эндотелиоцитов несут на себе рецепторы, которые при определённых условиях опосредуют связывание с молекулярными ли-гандами и клетками, свободно циркулирующими в кровотоке.
При отсутствии каких-либо повреждений выстилающие сосуд эндотелиальные клетки обладают тромборезистентными свойствами, что способ
ствует поддержанию жидкого состояния крови. Тромборезистентность эндотелия обеспечивают:
■ контактная инертность внутренней (обращённой в просвет сосуда) поверхности этих клеток;
■ синтез мощного ингибитора агрегации тромбоцитов — простаци-клина;
■ наличие на мембране эндотелиоцитов тромбомодулина, который связывает тромбин; при этом последний утрачивает способность вызывать свёртывание крови, но сохраняет активирующее действие на систему двух важнейших физиологических антикоагулянтов — протеинов С и S;
■ высокое содержание на внутренней поверхности сосудов мукополиса-харидов и фиксация на эндотелии комплекса гепарин-антитромбин III (АТШ);
■ способность секретировать и синтезировать тканевой активатор плаз-миногена, обеспечивающий фибринолиз;
■ способность стимулировать фибринолиз через систему протеинов С и S.
Нарушение целостности сосудистой стенки и/или изменение функциональных свойств эндотелиоцитов могут способствовать развитию протром-ботических реакций — антитромботический потенциал эндотелия трас-формируется в тромбогенный. Причины, приводящие к травме сосудов, весьма разнообразны и включают в себя как экзогенные (механические повреждения, ионизирующее излучение, гипер- и гипотермия, токсические вещества, в том числе и ЛС, и т.п.), так и эндогенные факторы. К последним относятся биологически активные вещества (тромбин, циклические нуклеотиды, ряд цитокинов и т.п.), способные при определённых условиях проявлять мембраноагрессивные свойства. Такой механизм поражения сосудистой стенки характерен для многих заболеваний, сопровождающихся склонностью к тромбообразованию.
Все клеточные элементы крови принимают участие в тромбогенезе, но для тромбоцитов (в отличие от эритроцитов и лейкоцитов) прокоагулянт-ная функция является основной. Тромбоциты не только выступают в качестве главных участников процесса тромбообразования, но также оказывают существенное влияние на другие звенья гемокоагуляции, обеспечивая активированные фосфолипидные поверхности, необходимые для реализации процессов плазменного гемостаза, высвобождая в кровь ряд факторов свёртывания, модулируя фибринолиз и нарушая гемодинамические константы как путём транзиторной вазоконстрикции, обусловленной генерацией тромбоксана А2, так и путём образования и выделения митогенных факторов, способствующих гиперплазии сосудистой стенки. При инициации тромбогенеза происходит активация тромбоцитов (то есть активация тромбоцитарных гликопротеинов и фосфолипаз, обмен фосфолипидов, образование вторичных посредников, фосфорилирование белков, метаболизм арахидоновой кислоты, взаимодействие актина и миозина, Na+/H+-обмен, экспрессия фибриногеновых рецепторов и перераспределение ионов кальция) и индукция процессов их адгезии, реакции высвобождения и агрегации; при этом адгезия предшествует реакции высвобождения и агрегации тромбоцитов и является первой ступенью гемостатического процесса.
При нарушении эндотелиальной выстилки субэндотелиальные компоненты сосудистой стенки (фибриллярный и нефибриллярный коллаген,
эластин, протеогликаны и др.) вступают в контакт с кровью и образуют поверхность для связывания фактора фон Виллебранда, который не только стабилизирует фактор VIII в плазме, но и играет ключевую роль в процессе адгезии тромбоцитов, связывая субэндотелиальные структуры с рецепторами клеток [Баркаган З.С., 1998].
Адгезия тромбоцитов к тромбогенной поверхности сопровождается их распластыванием. Этот процесс необходим для осуществления более полного взаимодействия тромбоцитарных рецепторов с фиксированными лигандами, что способствует дальнейшему прогрессированию тромбооб-разования, так как, с одной стороны, обеспечивает более прочную связь адгезированных клеток с сосудистой стенкой, а с другой стороны, иммобилизованные фибриноген и фактор фон Виллебранда способны выступать в качестве тромбоцитарных агонистов, способствуя дальнейшей активации этих клеток.
Помимо взаимодействия с чужеродной (в том числе и повреждённой сосудистой) поверхностью, тромбоциты способны прилипать друг к другу, то есть агрегировать. Агрегацию тромбоцитов вызывают различные по своей природе вещества, например тромбин, коллаген, АДФ, арахидоно-вая кислота, тромбоксан А2 простагландины G2 и H2, серотонин, адреналин, фактор активации тромбоцитов и другие. Проагрегантами могут быть и экзогенные вещества (отсутствующие в организме), например латекс.
Как адгезия, так и агрегация тромбоцитов могут приводить к развитию реакции высвобождения — специфического Са2+-зависимого секреторного процесса, при котором тромбоциты выделяют ряд веществ в экстра-целлюлярное пространство. Индуцируют реакцию высвобождения АДФ, адреналин, субэндотелиальная соединительная ткань и тромбин. Вначале высвобождается содержимое плотных гранул: АДФ, серотонин, Са2+; для высвобождения содержимого а-гранул (тромбоцитарный фактор 4, Р-тромбоглобулин, тромбоцитарный фактор роста, фактор фон Виллебран-да, фибриноген и фибронектин) необходима более интенсивная стимуляция тромбоцитов. Липосомальные гранулы, содержащие кислые гидролазы, высвобождаются только в присутствии коллагена или тромбина. Следует отметить, что высвободившиеся из тромбоцитов факторы способствуют закрытию дефекта сосудистой стенки и развитию гемостатической пробки, однако при достаточно выраженном поражении сосуда дальнейшая активация тромбоцитов и их адгезия к травмированному участку сосудистой поверхности формирует основу для развития распространённого тромбо-тического процесса с последующей окклюзией сосудов.
В любом случае итогом повреждения эндотелиоцитов становится приобретение интимой сосудов прокоагулянтных свойств, что сопровождается синтезом и экспрессией тканевого фактора (тромбопластина) — основного инициатора процесса свёртывания крови. Тромбопластин сам по себе не обладает ферментативной активностью, но может выступать в роли кофактора активированного фактора VII. Комплекс тромбопластин/фактор VII способен активировать как фактор X, так и фактор XI, вызывая тем самым генерацию тромбина, что в свою очередь индуцирует дальнейшее прогрес-сирование реакций как клеточного, так и плазменного гемостаза.
Гемо статические реакции, совокупность которых принято называть плазменным (коагуляционным) гемостазом, в конечном итоге приводят
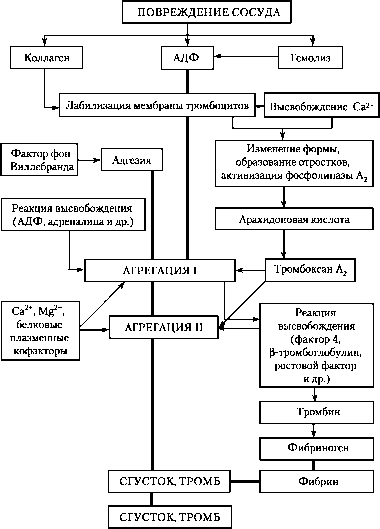
активация; — переход из одного состояния в другое
Рис. Тромбоцитарный гемостаз
к образованию фибрина; эти реакции преимущественно реализуются протеинами, носящими название плазменных факторов. В табл. приведён перечень факторов, участвующих в свёртывании крови.
Таблица Международная номенклатура факторов свёртывания крови
Таблица Международная номенклатура факторов свёртывания крови

* Синтезируются в печени.
* Синтезируются в печени.
Процесс плазменного гемостаза можно условно разделить на 3 фазы.
I фаза — образование протромбиназы или контактно-калликреин-ки-нин-каскадная активация. I фаза представляет собой многоступенчатый процесс, в результате которого в крови происходит накопление комплекса факторов, способных превратить протромбин в тромбин, поэтому этот комплекс называется протромбиназой. Различают внутренний и внешний пути формирования протромбиназы. По внутреннему пути свёртывание крови инициируется без участия тканевого тромбопластина; в образовании протромбиназы принимают участие факторы плазмы (XII, XI, IX, VIII, X), калликреин-кининовая система и тромбоциты. В результате инициации реакций внутреннего пути образуется комплекс факторов Ха с V, на фосфоли-пидной поверхности (фактор 3 тромбоцитов) в присутствии ионизированного кальция. Весь этот комплекс действует как протромбиназа, превращая протромбин в тромбин. Пусковой фактор этого механизма — XII, который активируется либо вследствие контакта крови с чужеродной поверхностью, либо при контакте крови с субэндотелием (коллагеном) и другими компонентами соединительной ткани при повреждении стенок сосудов; либо фактор XII активируется путём ферментативного расщепления (калликре-
ином, плазмином, другими протеазами). Во внешнем пути формирования протромбиназы основную роль играет тканевый фактор (фактор III), который экспрессируется на клеточных поверхностях при повреждении тканей и образует с фактором VIIa и ионами кальция комплекс, способный перевести фактор Х в фактор Ха, который и активирует протромбин. Кроме того, фактор Ха ретроградно активирует комплекс тканевого фактора и фактора VIIa. Таким образом, внутренний и внешний пути соединяются на факторах свёртывания. Так называемые «мосты» между этими путями реализуются через взаимную активацию факторов XII, VII и IX. Эта фаза продолжается от 4 мин 50 с до 6 мин 50 с .
II фаза — образование тромбина. В эту фазу протромбиназа вместе с факторами коагуляции V, VII, X и IV переводит неактивный фактор II (протромбин) в активный фактор IIа — тромбин. Эта фаза продолжается 2-5 с.
III фаза — образование фибрина . Тромбин отщепляет от молекулы фибриногена по два пептида А и В, переводя его в фибрин-мономер. Молекулы последнего полимеризуются сначала в димеры, затем в ещё растворимые, особенно в кислой среде, олигомеры, и в конечном итоге в фибрин-полимер. Кроме того, тромбин способствует превращению фактора XIII в фактор ХШа. Последний в присутствии Са2+ изменяет фибрин-полимер из лабильной, легко растворимой фибринолизином (плазмином) формы в медленно и ограниченно растворимую форму, составляющую основу кровяного сгустка. Эта фаза продолжается 2-5 с.
В процессе образования гемостатического тромба распространения тром-бообразования от места повреждения стенки сосуда по сосудистому руслу не происходит, так как этому препятствуют быстро возрастающий вслед за свёртыванием антикоагулянтный потенциал крови и активация фибрино-литической системы.
Сохранение крови в жидком состоянии и регуляция скоростей взаимодействия факторов во все фазы коагуляции во многом определяются наличием в кровотоке естественных веществ, обладающих антикоагулянтной активностью. Жидкое состояние крови обеспечивает равновесие между факторами, индуцирующими свёртывание крови, и факторами, препятствующими его развитию, причём последние не выделяются в отдельную функциональную систему, так как реализация их эффектов чаще всего невозможна без участия прокоагуляционных факторов. Поэтому выделение антикоагулянтов, препятствующих активации факторов свёртывания крови и нейтрализующих их активные формы, весьма условно. Вещества, обладающие антикоагулянтной активностью, постоянно синтезируются в организме и с определённой скоростью выделяются в кровоток. К ним относятся АТШ, гепарин, протеины С и S, недавно открытый ингибитор тканевого пути свёртывания — TFPI (ингибитор комплекса тканевой фактор-фактор VIIа-Са2+), а2-макроглобулин, антитрипсин и др. В процессе свёртывания крови, фибринолиза из факторов свёртывания и других белков также образуются вещества, обладающие антикоагулянтной активностью. Антикоагулянты оказывают выраженное действие на все фазы свёртывания крови, поэтому исследование их активности при нарушениях свёртывания крови очень важно.
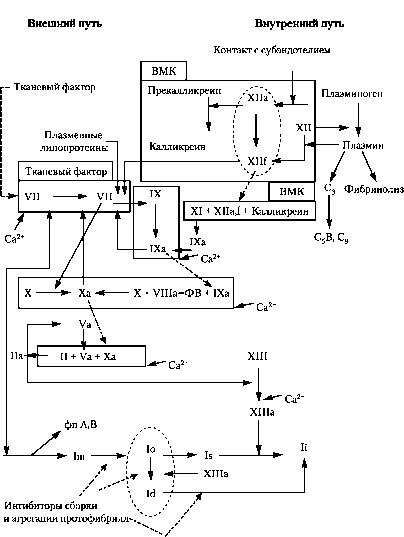
Рис. Плазменный гемостаз. ВМК — высокомолекулярный кининоген; РФМК — растворимые фибрин-мономерные комплексы; фп А и В — фибринопептиды А и В; С3, С5В, С9 — факторы системы комплемента
Рис. Плазменный гемостаз. ВМК — высокомолекулярный кининоген; РФМК — растворимые фибрин-мономерные комплексы; фп А и В — фибринопептиды А и В; С3, С5В, С9 — факторы системы комплемента
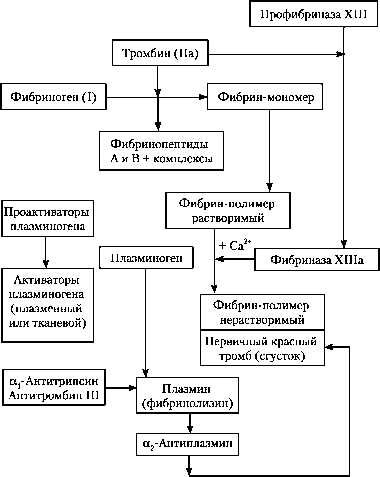
Рис. III фаза свёртывания крови (образование фибрина)
После стабилизации фибрина, вместе с форменными элементами образующего первичный красный тромб, начинаются два основных процесса посткоагуляционной фазы — спонтанный фибринолиз и ретракция, приводящие в итоге к формированию гемостатически полноценного окончательного тромба. В норме эти два процесса протекают параллельно. Физиологический спонтанный фибринолиз и ретракция способствуют уплотнению тромба и выполнению им гемостатических функций. В этом процессе активное участие принимают плазминовая (фибринолитическая) система и фибриназа (фактор XIIIa). Спонтанный (естественный) фибринолиз отражает сложную реакцию между компонентами плазминовой системы и фибрином. Плазминовая система состоит из четырёх основных компонентов: плазминогена, плазмина (фибринолизина), активаторов проферментов фибринолиза и его ингибиторов . Нарушение соотношений компонентов плазминовой системы приводит к патологической активации фибринолиза.
В клинической практике исследование системы гемостаза преследует следующие цели:
■ диагностика нарушений системы гемостаза;
■ выяснение допустимости оперативного вмешательства при выявленных нарушениях в системе гемостаза;
■ проведение контроля за лечением антикоагулянтами прямого и непрямого действия, а также тромболитической терапией.